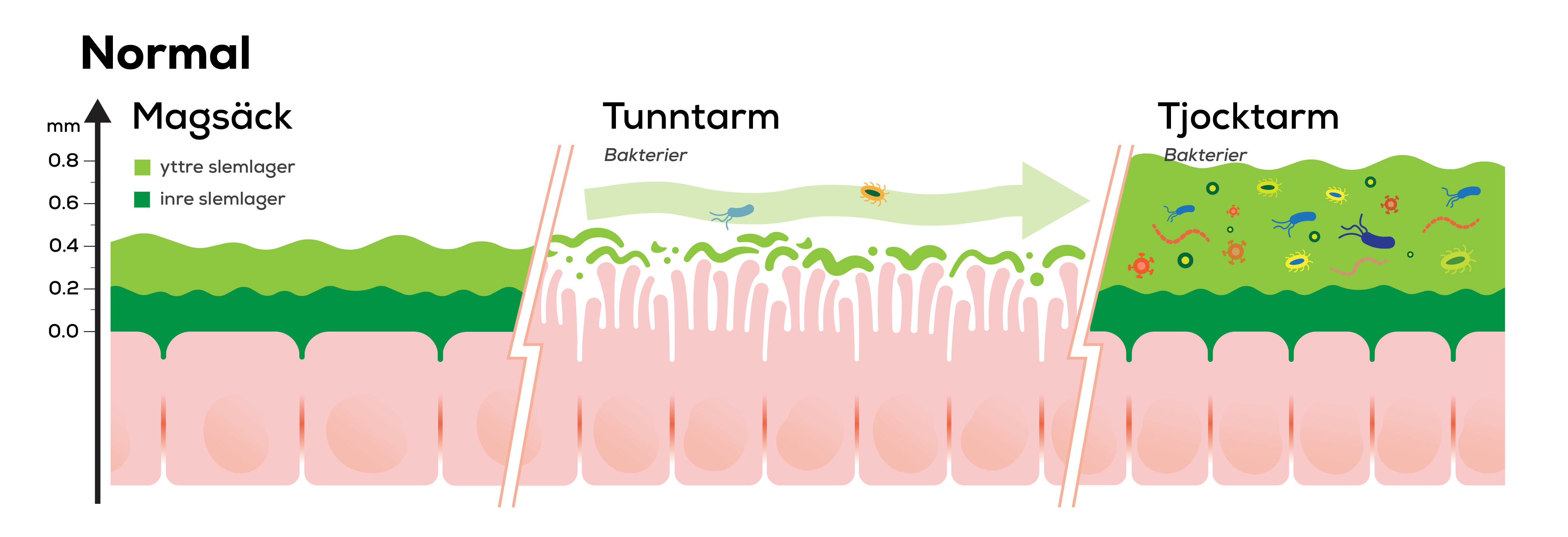
Tunntarmen är ett organ som innehåller en stor ansamling av immunceller. Det uppskattas att upp till 70% av kroppens immunceller finns längs tunntarmens vägg. Denna höga koncentration av immunceller är inte förvånande med tanke på den ständiga exponeringen av främmande ämnen från de 1-2 ton mat som vi årligen får i oss; ämnen som vårt immunsystem antingen ska tolerera (vår kost) eller reagera på (sjukdomsframkallande mikrober). Immunsystemet i tunntarmen är framför allt lokaliserat i små lymfknutor som kallas Peyers plack (Figur 2).
Ett exempel på att immunsystemet i tunntarmen kan reagera på oönskade bakterier visar erfarenheterna från oral vaccination mot kolerabakterien. När vi druckit avdödade kolerabakterier hamnar dessa på specialiserade celler i tunntarmens väg som transporterar kolera-antigen från tarminnehållet till Peyers plack. Efter två dricksglas av koleravaccin är vårt immunsystem förberett för en snabb immunrespons om vi skulle smittas av kolerabakterier i framtiden.
Exemplet med oral vaccination visar hur intimt innehållet i tunntarmen är kopplat till immunsystemet och att bakterieprodukter med lätthet kan passera igenom det tunna tarmslemmet till immunkompetenta celler i tunntarmsväggen och starta en reaktion som resulterar i ett immunsvar, det vill säga en godartad inflammation (6).
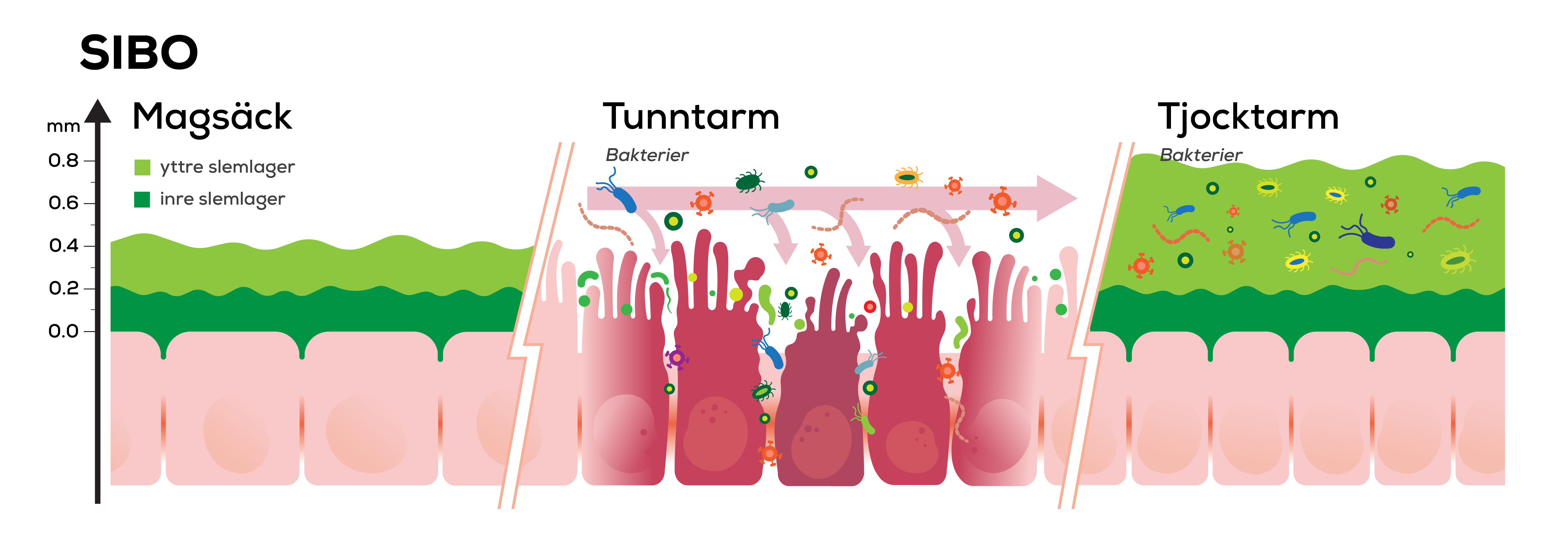
Till skillnad från situationen vid oral vaccination, där tarmens immunceller exponeras för bakterier endast vid 2-4 vaccinationstillfällen och därefter kan återgå till normala (lugna) förhållanden, så är situationen helt annorlunda vid SIBO, eftersom tarmens immunceller då ständigt aktiveras av bakterietoxinerna LPS och LTA från ovälkomna bakterier som frodas i tunntarmen och som därigenom kan orsaka en kronisk inflammation. Tunntarmens immunceller är vid SIBO överaktiva och har en rubbad funktion.